上一篇《關于美白那些事兒》推文中講到,皮膚變黑的影響因素有很多,為達到美白效果,我們可以通過不同的生物化學通路抑制或調節黑色素的生成、轉運和代謝,如抑制酪氨酸酶活性、干擾黑色素合成、阻斷黑色素轉運、加速黑色素分解以及抗氧化和抗炎作用等。那么接下來,就讓我們一起來看看依據不同抑制途徑構建的體外細胞培養模型及祛斑美白功效評估方式吧!
1.酪氨酸酶活性抑制實驗
酪氨酸酶是黑色素合成的關鍵酶,它催化酪氨酸轉化為黑色素的前體。抑制這一酶的活性可直接減少黑色素產生。采用生化反應法可測定酪氨酸酶活性抑制率。
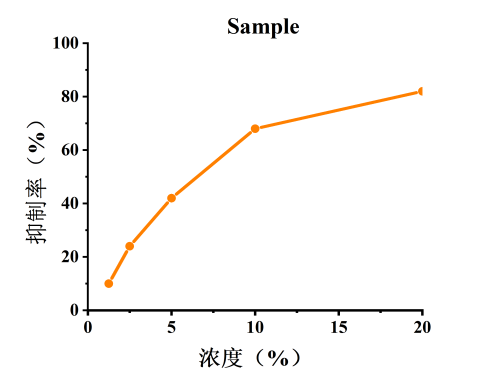
圖1 酪氨酸酶活性抑制率
隨著樣品濃度的升高,酪氨酸酶活抑制率逐漸上升,樣品具有良好的美白祛斑功效。
參考標準:T/SHRH 015-2018化妝品-酪氨酸酶活性抑制實驗方法
2.酪氨酸酶活性和黑素含量測定(B16-F10)
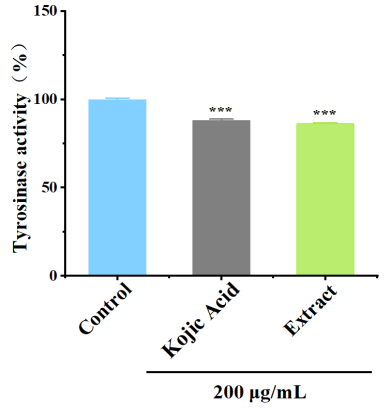 | 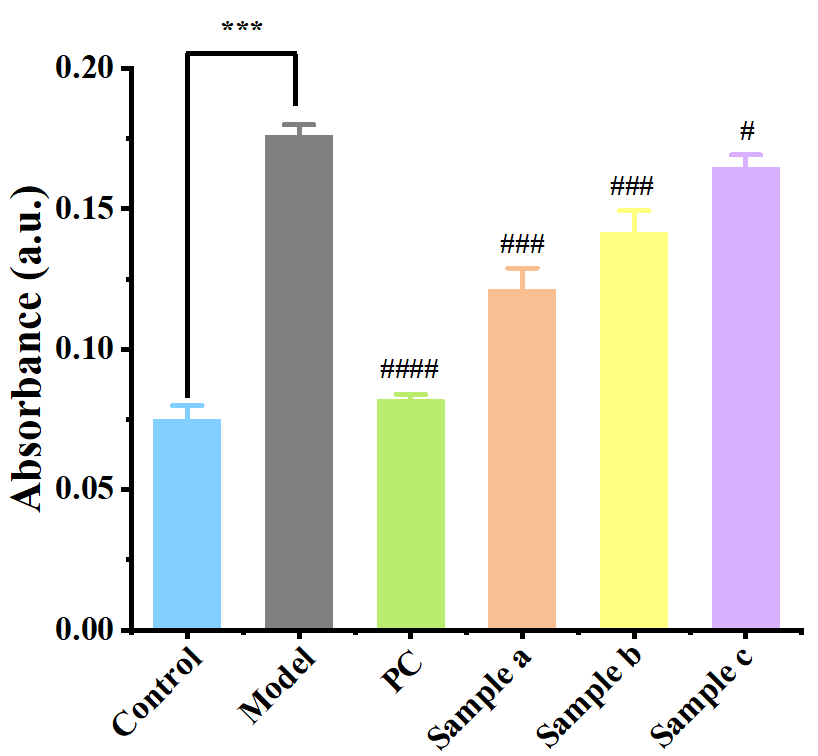 |
圖2 酪氨酸酶活性抑制率 圖3 黑素含量
樣品組酪氨酸酶活力顯著下降,黑素含量減少,表明樣品具有良好的美白祛斑功效。
黑素細胞體外培養實驗
小鼠B16黑色素瘤細胞和人A375黑色素瘤細胞模型通常被用于實驗。小鼠B16細胞因能夠多次傳代、生長速度快和對培養條件要求相對較低等特點,成為美白功效評估的優選細胞。但該細胞與人體內的黑素細胞仍存在一定差異,且多次傳代后產黑素能力下降。通常需采取重新引種、體內成瘤再培養、優化培養條件、基因工程技術轉染表達黑素合成關鍵酶的基因等方式恢復其高表達狀態。因此,B16細胞常用于初步或高通量篩選,但在最終應用于人類前,還需通過人類細胞或臨床數據驗證。
A375細胞來自于人類黑色素瘤,其生物學特性和變化更能反映人類細胞的實際響應,對研究黑色素生成和美白成分的功效具有重要意義;疾病相關性更高,使用這些細胞進行的研究更具臨床相關性,尤其在探索可能的治療方法或美白機制方面;使用人類細胞可以更準確地評估藥物的效果和安全性,更好地模擬藥物在人體內的作用。但A375細胞的培養條件更苛刻,成本較高,實驗操作更復雜。
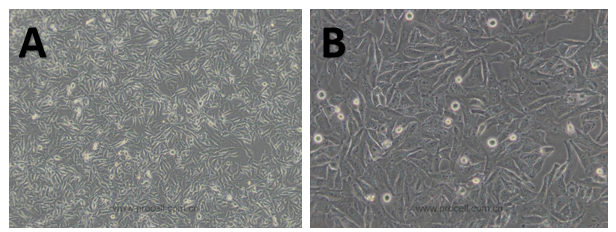
圖4 體外正常培養的B16黑色素瘤細胞和A375黑色素瘤細胞(A: B16F10; B: A375)
3.黑色素瘤細胞基因表達測定(B16-F10)
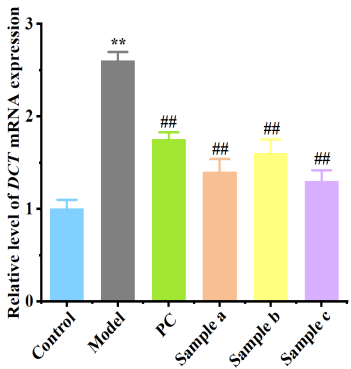 | 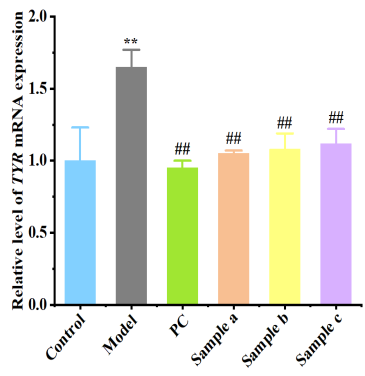 |
圖5 黑色素瘤細胞基因表達測定
樣品組黑素細胞相關基因表達下調,表明樣品具有良好的美白祛斑功效。
4.黑色素瘤細胞樹突長度和數量測定(MNT-1)
黑色素細胞樹突數量增加,樹突長度變長,會促進黑色素向角質形成細胞的轉移,如果測試物對這種情況有抑制,則樹突數量會減少且長度變短。
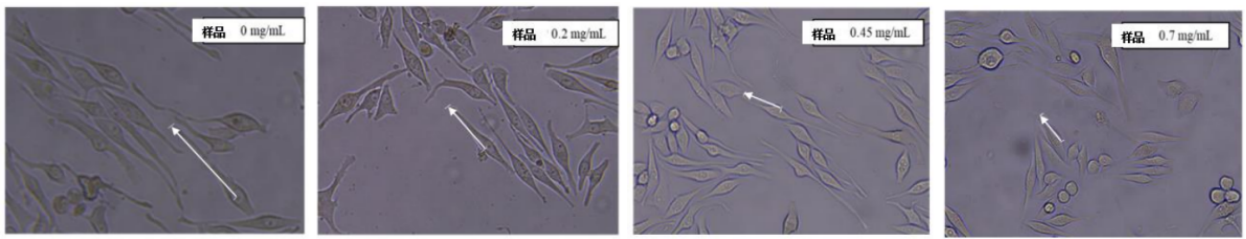
圖6 黑色素瘤細胞樹突長度和數量測定
隨著濃度的增加,黑素細胞樹突數量減少長度變短,樣品具有良好的美白祛斑功效。
黑素細胞與角質形成細胞共培養實驗
黑素傳遞是皮膚中黑色素細胞(Melanocytes,MC)與角質形成細胞(Keratinocytes,KC)之間的一個關鍵過程,它涉及黑素從MC轉移到KC,以保護皮膚免受紫外線(UV)輻射的傷害。首先,黑素細胞在其黑素體(一種特化細胞器)中合成黑素,此過程主要受到酪氨酸酶(Tyrosinase)和其他相關酶的催化;黑素合成后,黑素體會在黑素細胞內成熟并被運輸到細胞末梢(依賴于細胞骨架的動力學和相關運輸蛋白);隨后,黑素細胞與角質形成細胞通過其突起(或稱黑素細胞突觸)形成物理接觸。黑素體通過這些突起被運送到與角質形成細胞的接觸點,通過“細胞吞噬”(Cytocytosis)過程釋放到角質形成細胞。角質形成細胞通過一種類似于吞噬的機制(可能涉及內吞作用)接收黑素體。一旦進入角質形成細胞,黑素體被運輸到細胞核周圍,形成保護屏障,幫助屏蔽DNA免受紫外線引起的損傷。
在人體內部,一個黑色素細胞(MC)能夠與10至36個角質形成細胞(KC)建立聯系,并向它們傳遞黑素。在實驗室條件下,通過調整兩種細胞的培養比例,將永生化人表皮角質形成細胞系HaCaT與人類黑色素瘤細胞MNT-1共培養構建體外“表皮黑素單元”模型,可用于研究黑素細胞與角質形成細胞的交互作用,評估產品美白效果。
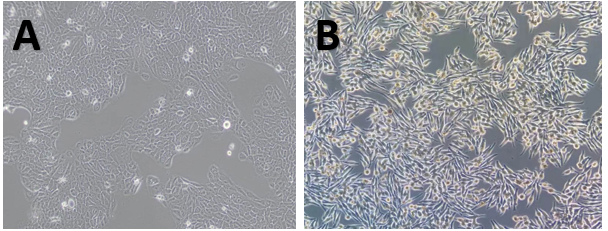
圖7 體外正常培養的HaCaT細胞和MNT-1黑色素瘤細胞(A: HaCaT; B: MNT-1)
5.黑色素轉移測定(HaCaT- MNT-1共培養,IF)
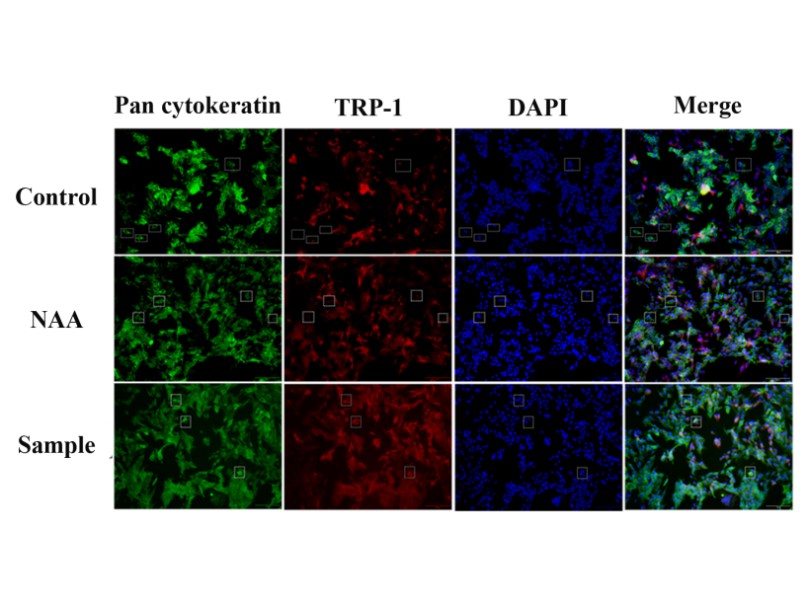
圖8 熒光染色黑素轉移測定
樣品組紅色熒光強度下降,表明黑色素轉移受到抑制,樣品具有良好的美白祛斑功效。
6.黑色素轉移測定(HaCaT-黑素小體共培養)
在體外評估美白產品的功效時,使用黑素小體(melanosomes)和角質形成細胞共培養的方法是可行的。黑素小體是黑色素細胞產生的細胞器,主要負責儲存和轉運黑色素。通過將這些黑素小體直接與角質形成細胞共培養,可以模擬黑素從黑色素細胞到角質形成細胞的轉移過程,直接評估美白成分對黑素小體的影響,如抑制黑素的吞噬或影響其在角質形成細胞中的分布和穩定。
但黑色素細胞不僅僅是黑素的生產單位,它們還參與許多調控過程,如黑素的合成、成熟、分泌等。僅使用黑素小體可能無法完全復制這些復雜的生物學過程。黑素小體需要從黑色素細胞中提取,這一過程復雜且難以標準化,黑素小體的質量和活性可能因提取方法而異。
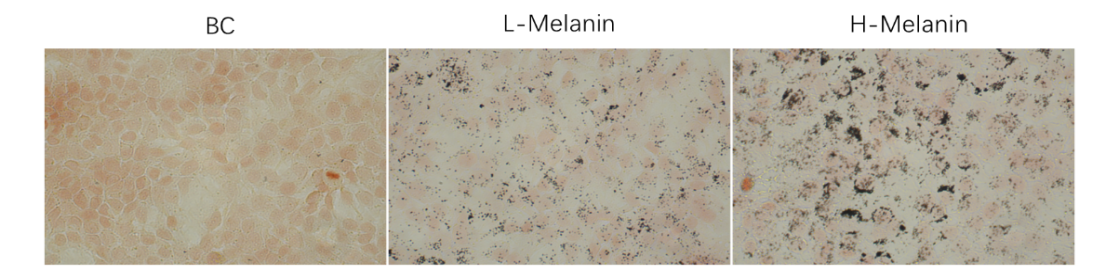
圖9 黑素轉移顯微鏡圖
給予黑色素粗提物后細胞中明顯可見黑色素的存在,并分布于細胞核周圍,形成“核上帽”,增加裂解的黑色素細胞數量可以獲得更多黑色素體,并使角質形成細胞中黑色素量增加,轉移實驗結果更顯著。
參考文獻:
- Hugo M ,C. M S ,C. D B .Melanin Transfer in the Epidermis: The Pursuit of Skin Pigmentation Control Mechanisms[J].International Journal of Molecular Sciences,2021,22(9):4466-4466.
- Hui-Jun M ,Guang Z ,Shao-Xia Z , et al.Efficacy of quantifying melanosome transfer with flow cytometry in a human melanocyte-HaCaT keratinocyte co-culture system in vitro.[J].Experimental dermatology,2010,19(8):e282-5.
- Pillaiyar T ,Manickam M ,Jung S .Recent development of signaling pathways inhibitors of melanogenesis[J].Cellular Signalling,2017,4099-115.
- 郭立群,王敏.化妝品功效評價(Ⅶ)——細胞生物學在化妝品功效評價中的應用[J].日用化學工業,2018,48(07):371-377.DOI:10.13218/j.cnki.csdc.2018.07.002.
- 何文丹,劉磊,楊舒顏,等.化妝品功效評價(Ⅺ)——體外試驗技術在發用化妝品功效評價中的應用[J].日用化學工業,2019,49(01):5-11+33.
- 李配配,王敏,吳金昊,等.細胞培養技術在化妝品功效評價中的應用[C]//北京日化(2016年第3期 總第124期).北京工商大學;北京日化協會;,2016:5.
- 趙美娟,戶晶晶,倪輝,等.黑色素生成信號通路研究進展[J].生物工程學報,2019,35(09):1633-1642.DOI:10.13345/j.cjb.190084.

